病原性寄生虫「トキソプラズマ」に関する基礎医学研究について
大阪大学微生物病研究所・感染病態分野・教授 山本雅裕先生
▼ 状況に応じて姿を変える能力
▼ トキソプラズマの体内への侵入と増殖
▼ 宿主の免疫をかいくぐって生き残る能力
▼ トキソプラズマと免疫の攻防戦
▼ インターフェロンに誘導されたタンパク質がトキソプラズマを攻撃する
▼ 妊婦を守るためのワクチンの必要性
▼ トキソプラズマ研究の現状
▼ 寄稿いただいた山本雅裕先生のご紹介
地球上で最も感染拡大に成功した病原性原虫
トキソプラズマは主に東南アジアやアフリカ、中南米などで大きな問題となっているマラリアの原因病原体のマラリア原虫などと同じ胞子虫類原虫に分類されます。
マラリア原虫は宿主である人間(ヒト)やネズミ(マウス)などの種によってタイプが異なり、マウスのマラリア原虫がヒトに感染することはありませんし、逆にヒトのマラリア原虫はマウスには感染しません。
これに対して、トキソプラズマは一種類しか存在しないにも関わらず、ヒトやマウス、ネコはおろか、羊や豚などの食肉用の家畜をはじめ、極端な例でいうと海にいるアシカやクジラなどにも感染しています。
マラリア原虫の宿主域が狭い(感染可能な宿主の種類が少ない)のに対して、トキソプラズマの宿主域は非常に広いということが分かると思います。
ヒトに限って言えば、トキソプラズマは世界人口の三分の一(約20億人)が感染していると言われており、このことからトキソプラズマは「最も感染拡大に成功した病原性原虫である」としばしば形容されます。
- トキソプラズマはマラリア原虫の仲間。
- マラリア原虫はたくさん種類があるのに、トキソプラズマは一種類しかない。
- しかし、トキソプラズマは色んな動物に感染することができる。
- トキソプラズマに感染した人が世界中で20億人もいる。
状況に応じて姿を変える能力
トキソプラズマが我々宿主に感染した後に病気を引き起こすメカニズムを理解するためには、トキソプラズマの生活環を説明する必要があります。
トキソプラズマにはタキゾイト(急速増殖体)・ブラディゾイト(緩慢増殖体)・オーシスト(有性生殖分裂体)という3つの異なる形態があり、周囲の環境によって、この3つの形態を行き来します。
これは我々ヒトが春夏秋冬で衣替えするのをイメージすれば分かりやすいかと思います。
タキゾイト/ブラディゾイトとオーシストでは、原虫の増殖の仕方が大きく異なり、前者が無性生殖(すなわち、クローン増殖)を行うのに対して、後者は有性生殖(我々ヒトの生殖のように2体の異なる親トキソプラズマから半分ずつ遺伝子情報をもらって一つの新しい原虫が誕生します)を行います。
この有性生殖のためのオーシストの形成はネコの腸管でしか起きません。
これがネコはトキソプラズマの「終宿主」であるといわれる理由です。一方、タキゾイトとブラディゾイトが行う無性生殖はネコの腸管以外の場所、つまり我々ヒトを含む全ての恒温動物の中で起こり、特に「中間宿主」と呼ばれています。
オーシスト形成はネコの腸管で起きますから、オーシストに汚染されたネコの糞が転がっているような公園の砂場で遊び洗わないままの手が口に入る、あるいは糞が付着したガーデニングの野菜を食べることなどでオーシストが我々ヒトの体内に侵入します。
また後で述べるブラディゾイトに汚染された家畜の肉などをユッケやレア肉といった非加熱な状態で食べることによってもトキソプラズマはヒトの体内に侵入する可能性があります。
- トキソプラズマには異なる3つの形態(タキゾイト・ブラディゾイト・オーシスト)がある。
- タキゾイトとブラディゾイトは1つ1つの虫が分裂してクローンが増える。
- タキゾイトとブラディゾイトはヒトを含む全ての恒温動物の体内で増える。
- ブラディゾイトに汚染されたお肉を非加熱の状態で食べると感染する。
- オーシストは人の卵子と精子が受精するように、2つの原虫が合わさって誕生する。
- オーシストはネコの腸管内だけで形成される。
- オーシストに汚染された砂や土、野菜などが口に入ることでも感染する。
トキソプラズマの体内への侵入と増殖
どのような経路・形態にせよ、口を介してヒト(を含む全ての中間宿主)の体内に侵入したトキソプラズマのオーシストやブラディゾイトはやがて腸管に達し、そこで急速増殖体であるタキゾイトに変態します。
タキゾイトはやがて腸管にある白血球に感染して血流に乗り全身へと広がっていきます。
タキゾイトの増殖は速く約6時間ごとに分裂を繰り返し、1個のトキソプラズマは1日後には8個、2日後に128個になります。
トキソプラズマの大きさが3マイクロメートルで、白血球の100マイクロメートルと比較してもそう小さくありませんから、約2日もすると白血球の中がタキゾイトで充満された形になります。
最後には抱えきれなくなった白血球が食い破れるようにしてタキゾイトが出て、新たな白血球に感染して増殖が繰り返されます。
トキソプラズマにとって白血球に感染するというのは全身に広がっていけるという利点もありますが、白血球自身がトキソプラズマを含め全ての病原体の感染に対する防御を担う「免疫系」の細胞であるため、その中ではトキソプラズマは免疫系による原虫の増殖抑制あるいは破壊(殺傷)される可能性があります。
それに対して、タキゾイトは白血球などからストレスを受けると速やかにブラディゾイトになります。
ブラディゾイトは増殖が遅いのですが、シストと呼ばれるブラディゾイトに独特な球状の構造物を形成するのが特徴です。
シストの中にブラディゾイトが数十から数千含まれますが、シストは免疫系によるトキソプラズマの監視機構を逃れることができます。
シストが何故宿主の免疫系から逃れることができるのかについては今も詳しい理由が分かっていません。
- 口から入ったオーシストもしくはブラディゾイトは腸管でタキゾイトに変態する。
- タキゾイトは白血球内に侵入して増殖する。
- 白血球に運ばれてタキゾイトは全身に拡がる。
- 免疫系からの攻撃が始まるとタキゾイトはブラディゾイトに変態する。
- ブラディゾイトはシストと呼ばれる構造物を作り、免疫系から逃れる。
宿主の免疫をかいくぐって生き残る能力
免疫系にやられるかもしれないという危険を冒しながらタキゾイトは白血球に身を潜め全身に広がりますが、ほとんどのタキゾイトは徐々に態勢を立て直した宿主の免疫系に結局は排除されてしまいます。
しかし、宿主の免疫系が強くは働くことができない臓器である脳や筋肉に達することができたタキゾイトは、原虫にとっては適度に抑制された免疫系とのバランスの中でブラディゾイトになりシストを形成して増殖スピードを落とす(ほとんど増殖しない)ことで、一見トキソプラズマ感染などなかったかのように終生宿主の中に潜み続けます。
これがいわゆる「日和見感染」の成立で、通常の健常人であればこのまま一生トキソプラズマがシストのまま保たれ二度と顔を表に出すことは無いと考えられます。
- 体内で増えたほとんどのタキゾイトは免疫系によって排除される。
- しかし、脳や筋肉の中ではシストを形成して潜み続けることができる。
- 健康な人であれば、シストがあったとしても生涯トキソプラズマが目覚めることはない。
トキソプラズマと免疫の攻防戦
では我々の免疫系はトキソプラズマに対して一体何をしているのでしょうか?まずタキゾイトが感染するのは白血球の中でもマクロファージや樹状細胞といった「自然免疫系担当細胞」です。
「自然免疫」とは全ての生物が生まれながらにして持つ免疫系で、2011年のノーベル医学・生理学賞は、この自然免疫の概念と実体の発見に対して与えられました。
自然免疫系細胞により、トキソプラズマ自身を構成するDNAやRNAなどの核酸やタンパク質がマクロファージや樹状細胞によって認識されて、その結果インターフェロンを産生する「獲得免疫」系が活性化します。
「獲得免疫」とは我々ヒトを含めた魚類以上の高等動物にしかない免疫系で、大量のガンマーインターフェロン(IFN-γ)の産生を誘導するもう一つの免疫系です。
このインターフェロンというタンパク質は、それ自身は直接トキソプラズマに対して何か作用して傷害を与えたりはしませんが、自然免疫系細胞に作用して原虫の増殖を抑制する一酸化窒素の合成や原虫が増殖するのに必須のアミノ酸の一つであるトリプトファンを分解する機構を誘導するという重要な役割を果たします。
イメージとしては、一酸化窒素はタキゾイトの増殖する気を無くしてしまうガスで、トリプトファンの分解は兵糧攻めといったところでしょうか。
- タキゾイトが感染するのは「自然免疫」を担当する細胞。
- ヒトの体内では「自然免疫」の働きにより「獲得免疫」が活性化される仕組みがある。
- 「獲得免疫」の働きで大量のインターフェロンが産生される。
- インターフェロンは直接トキソプラズマを殺すことはできない。
- しかし、ガス産生や栄養分解を誘導することでトキソプラズマの増殖を抑える。
インターフェロンに誘導されたタンパク質がトキソプラズマを攻撃する
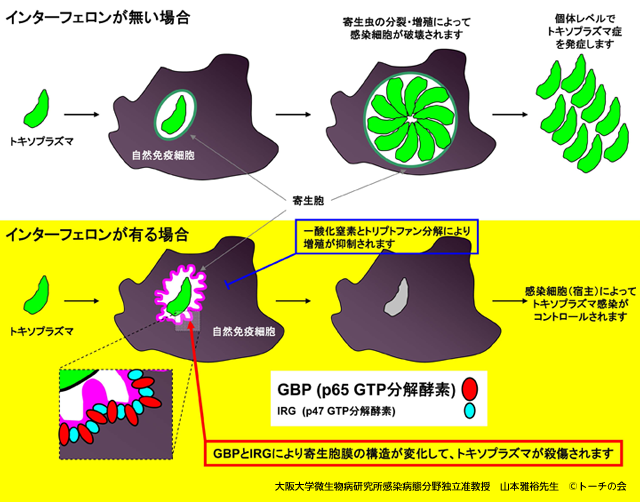
さらにインターフェロンで自然免疫細胞が刺激されると積極的にタキゾイトの殺傷も起きます。
トキソプラズマのタキゾイトは細胞に感染すると裸のままで存在するのではなくて、「寄生胞」と呼ばれる構造物の中で増殖します。
この寄生胞はいわば家(細胞)の中のテントがあるような状態をイメージしてもらえると分かりやすいかもしれませんが、その中に身を隠して宿主の細胞から原虫の増殖に必要な食べ物(栄養分)をとっています。
これは「寄生(パラサイト)」の典型的な例だと思います。
インターフェロンが作用すると、宿主細胞ではIRGやGBPと呼ばれる酵素群が誘導されます。
これらIRGやGBPの詳しい機能は分かっていませんが、IRGやGBPは寄生胞と宿主の細胞の中を隔てている膜(寄生胞膜)に蓄積して、寄生胞膜の構造をボロボロにすることがごく最近分かってきました。つまり、IRGやGBPなどがドリルのように機能して、テント(寄生胞膜)に穴をたくさん開けて、ビリビリに破るようなイメージです。
裸にされたトキソプラズマは細胞の中では色々な免疫系による攻撃を受けやすくなると考えられますが、具体的にどのような攻撃手段が宿主自然免疫系にはあるのかほとんど分かっていません。
ただインターフェロンという一つのタンパク質が自然免疫細胞に作用すると、約2000種類(IRGやGBP、一酸化窒素を合成する酵素、トリプトファン分解酵素などもこの中に含まれます)の別のタンパク質が極めて速やかに誘導されることを考えると、「インターフェロンにより誘導されるタンパク質群がどのようにしてトキソプラズマの増殖を止め、そして殺傷するのか」についてのメカニズムの解明が今後の研究の中心になると 思います。
- 細胞に感染したタキゾイトは「寄生胞膜」に包まれて、身を隠している。
- タキゾイトは「寄生胞膜」を通して、細胞から栄養分を奪っている。
- インターフェロンが誘導するIRGやGBPと呼ばれる物質は「寄生胞膜」を破壊する。
- インターフェロンは他にも約2,000種類の物質の産生を誘導する。
- しかし、これらの物質の働きは多くが未知である。
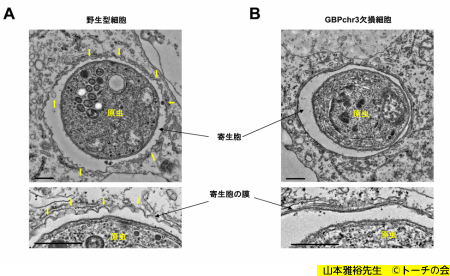
トキソプラズマと寄生胞
野生型細胞では寄生胞の膜が波打ち、破壊される(A)が、
GBPを欠損すると寄生胞の膜に変化が見られない(B)
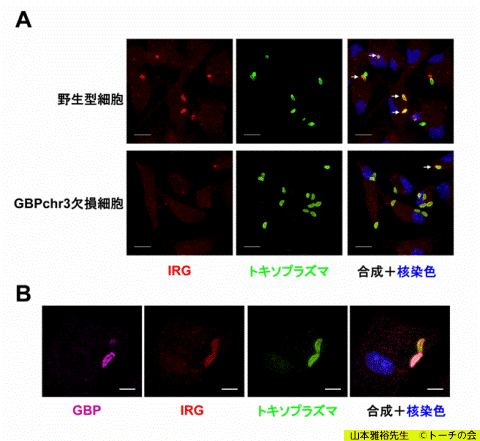
(A) GBPを欠損するとトキソプラズマ破壊因子IRGがトキソプラズマに動員されなくなる
(B) GBPとIRGはトキソプラズマに集まり、協調して破壊する
妊婦を守るためのワクチンの必要性
健常人では問題のないトキソプラズマ感染がどうして「妊婦が初感染する」と問題になるのでしょうか?元々トキソプラズマ症の研究はエイズ(後天性免疫不全症候群)の研究と一緒になって進展してきた経緯があります。
エイズでは名前の如く免疫不全が起きますが、前に書いたインターフェロンが大量に産生される獲得免疫系が働かなくなることが、その免疫不全の主な原因です。
当たり前ですが、「妊娠」というのはエイズのような病気ではありません。
しかし、胎児という半分が自分ではない異物を自分の免疫系が拒絶しないために、妊娠中の母体では免疫が「不完全」な状態になっています。
特に胎児・胎盤周辺では免疫不全状態になっており、このことが母体では問題のないトキソプラズマが胎児・胎盤で活動して問題となる原因になっています。
従って妊娠時に初感染が起こりうる女性に対しては、「妊娠前」にトキソプラズマに対する獲得免疫系をあらかじめ誘導し、その後に妊娠をしてもらうという目的のために、トキソプラズマに対するワクチンの開発などが今後の検討課題です。
またシストを形成して免疫系を逃れるだけでなく、トキソプラズマが感染細胞内で宿主の自然免疫系を抑制する機構が解き明かされつつあり、ヒトでの疾患との関係についての知見もまだまだ広がりを見せそうです。
- 獲得免疫が働かなくなるエイズの場合にはトキソプラズマが問題となる。
- トキソプラズマに感染したことがなかった女性が妊娠中に感染した場合に問題となる。
- その理由は、妊娠中の母体では免疫が不完全な状態になるため。
- ただし、妊娠中の母体ではなく、トキソプラズマは胎児や胎盤に悪影響を及ぼす。
- 妊娠前に用いるワクチンの開発や免疫系との関連を調べる研究が進む。
トキソプラズマ研究の現状
トキソプラズマが何故病気を起こすのかについてはまだまだ謎な点が多く、われわれ宿主の側(免疫系)と病原体側(トキソプラズマ)の両方面からの研究を車の両輪のように進めていくことが、この病原体の総合的な理解に繋がると思います。
しかし日本ではトキソプラズマの基礎的な研究の層が欧米に比べて非常に薄く、欧米の高いレベルについていくのが非常に困難な状況です。
「寄生虫病」という感染症が日本では「過去の病気」として扱われていること、またトキソプラズマに限っていえば健常人では問題の無い日和見感染症の一つに過ぎないなどの理由により、トキソプラズマに関する純粋な基礎医学あるいは臨床医学研究のための潤沢な研究資金の獲得が困難なことが一因であると思われます。
従って日本におけるトキソプラズマの基礎医学研究者はトキソプラズマを扱いながらも、宿主側の学問である「免疫学」の一環として研究する、同じ胞子虫類原虫である重要病原体マラリア原虫に“似た”モデル生物として捉え「マラリア学」の一部として研究する、あるいはトキソプラズマが家畜の伝染病であることから「獣医畜産学」の一環として研究する、というように、本業(基礎医学としてのトキソプラズマ学)とは異なる分野でいわば「アルバイト」的な研究をしながら、それぞれが細々と研究しているのが実情です。
トキソプラズマ症が「難病指定」されるというのは社会的なインパクトをもたらしますし、それを目指して日本におけるトキソプラズマの基礎医学研究者も欧米に引けを取らず社会に認められるような研究成果を絶えず発信していかなければならない使命があると思い、日々研究を行っているところです。
- 免疫系の研究とトキソプラズマの研究、両方面からの研究が大事。
- 欧米のトキソプラズマ研究はレベルが高い。
- 日本のトキソプラズマの研究者の多くは、医学以外の分野で研究を続けている。
- トキソプラズマ症の重要性が認識されるように、日本での医学研究も進めたい。
寄稿いただいた山本雅裕先生のご紹介
 大阪大学微生物病研究所・感染病態分野・教授
大阪大学微生物病研究所・感染病態分野・教授
山本雅裕
大阪大学研究者総覧による紹介
▼研究内容・専門分野
細胞内寄生性原虫感染に対する宿主自然免疫応答を分子遺伝学的手法で解明する
分子生物学,免疫学,寄生虫学(含衛生動物学)
2013/03/31(日) 第82回日本寄生虫学会大会 大会3日目 ワークショップⅡ「先天性トキソプラズマ症の現状と課題」で発表されました。
▼トキソプラズマに関するメディア掲載等
大阪大学 [2012/07/13] トキソプラズマ症の発病を防ぐ最重要宿主防御因子GBPを同定―インターフェロン誘導性タンパクGBPは寄生虫「トキソプラズマ」を破壊するー
マイナビニュース [2012/07/13] 阪大、トキソプラズマを破壊する宿主防御因子GBPを発見
日刊工業新聞 [2011/09/01] 阪大など、人畜共通寄生虫病「トキソプラズマ」の発病因子を特定
日本経済新聞 [2011/6/13] 阪大とジュネーブ大、トキソプラズマ症の発症メカニズム解明
妊娠中の感染予防のための注意事項-11か条
11か条をかわいいイラスト付きでプリントサイズにまとめました。 トキソプラズマやサイトメガロウイルスの予防だけでなく、妊娠中の様々な感染症からの予防について書かれています。妊娠中の方も、周りに妊婦さんがいる方も、知っていただきたい内容です。\ NEW / 印刷して見える所に貼ろう! 11か条イラスト版PDF